查詢時請注意選擇相應的產品編號
| 原子和分子結構標識它的元素和它的質子數 | |||
|---|---|---|---|
|
積木物質原子連接在一起形成分子或化合物。重要的是要知道的部分原子,離子和同位素原子如何一起。一個Atom零件原子是由三個部分組成:
質子 - 正電荷
中子 - 沒有電荷
電子 - 負電荷
質子和中子構成的各原子的核或中心。電子繞原子核。所以,細胞核的每個原子有一個凈正電荷,而原子的外側部分有一個凈負電荷。在化學反應中,原子失去,增益,或共用電子。細胞核內不參與普通的化學反應,雖然核衰變和核反應可能會導致在原子核的變化。
原子,離子,同位素
原子中的質子數確定它是哪一個元素。每個元素有一個或兩個字母的符號,是用來識別它的化學式和反應。他符號氦。原子與兩個質子氦原子,不管它有多少個中子或電子。原子,可以具有相同數目的質子,中子,電子,或中子的數目和/或電子可能不同于質子的數目。
帶有凈正電荷或者負電荷的原子,離子。例如,如果一個氦原子失去兩個電子,它有一個將被寫入他2 + 2,凈電荷。
變的原子中的中子數決定它是一個元素的同位素。原子可以被寫入與核符號,以確定它們的同位素,其中列出的元素符號的上方和左側的核子數(質子和中子),與下面列出的質子數和左側的符號。例如,3個氫的同位素是:1 H,1,3 1 H 2 1 H
既然你知道從來沒有改變一個元素的一個原子的質子數,更常見的是用元素符號和核子數同位素。例如,你可以寫H-1,H-2,H-3三個氫的同位素U-236和U-238兩種常見的鈾同位素。
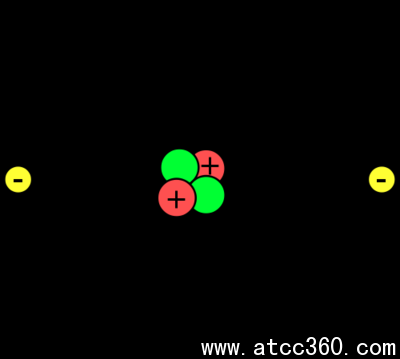
原子序數和原子量一個原子的原子數的標識它的元素和它的質子數。質子和中子的數目中的一個元素(原子量是多少,因為電子的質量與質子和中子,它本質上不計數)相比是如此之小。的原子量有時被稱為原子質量或原子質量數。氦的原子數為2。氦的原子量為4。請注意,在周期表上的元素的原子質量的是不是一個整數。例如,氦原子的質量為4.003,而不是4。這是因為周期表中反映的元素的同位素的天然豐度。在化學計算中,您可以使用給定的周期表上的原子量,假設一個元素的樣本,反映了該元素的同位素的自然范圍。
分子原子彼此交互,往往互相形成化學鍵。當兩個或兩個以上的原子相互鍵合,便形成了分子。可以是簡單的分子,如H 2,或更復雜的,如C 6 H 12 O 6。下標表示的每一種類型的在一個分子中的原子的數目。第一個例子中描述了一種由兩個氫原子形成的分子。第二個例子中描述了一種形成由6個碳原子的,12個氫原子,和6個原子的氧分子。雖然你可以以任何順序寫入的原子,分子帶正電過去的慣例是寫第一,其次由帶負電荷的分子。所以,被寫入氯化鈉NaCl和ClNa。
|
| 上一篇:化學元素周期表的說明和審查 | 下一篇:化學和物理特性和變化 |
|---|
無法在這個位置找到: xy/left.htm
